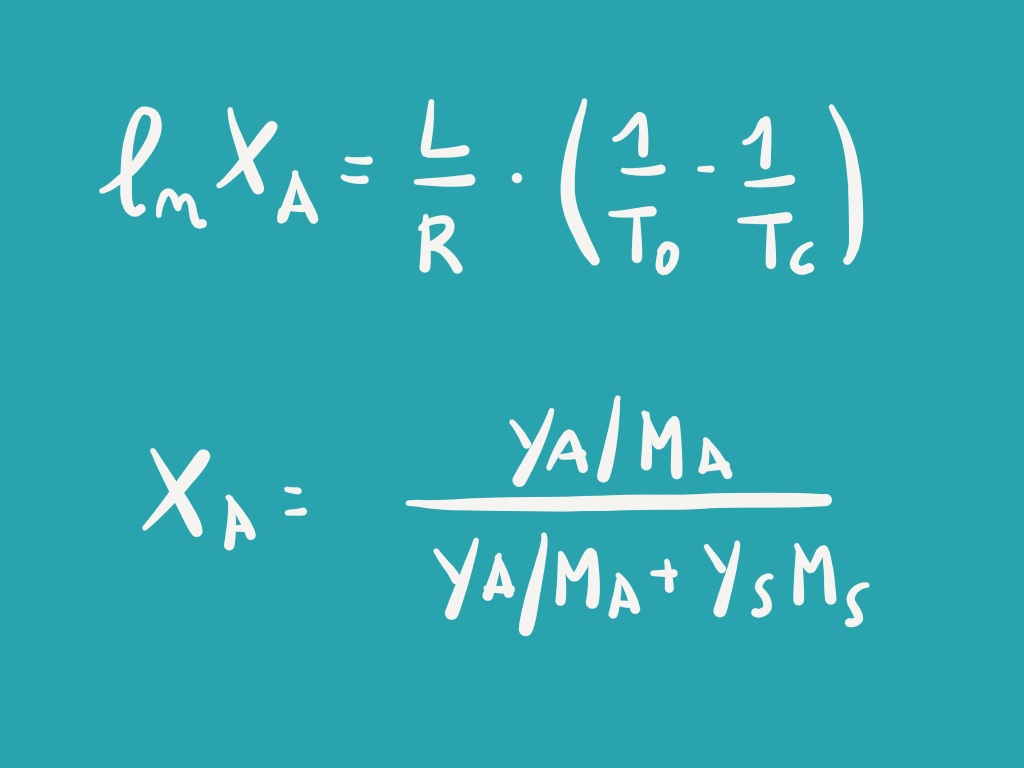Inulina

Inulina (Ita), inulin (Eng), inuline (Fra), inulina (Esp), inulin (Deu).
Categoria funzionale: fibra, addensante, gelificante, legante, dolcificante, prebiotico.
Numero CAS: [9005-800-5].
Formula bruta: C6H11O4(C6H11O4)nOH (n può variare in genere da 2 a 60).
Peso Molecolare: ≈ 5000.
Forma: polvere fine bianca cristallina.
Densità media (tapped, g/l): 0,65.
Punto di fusione (°C): 175-180.
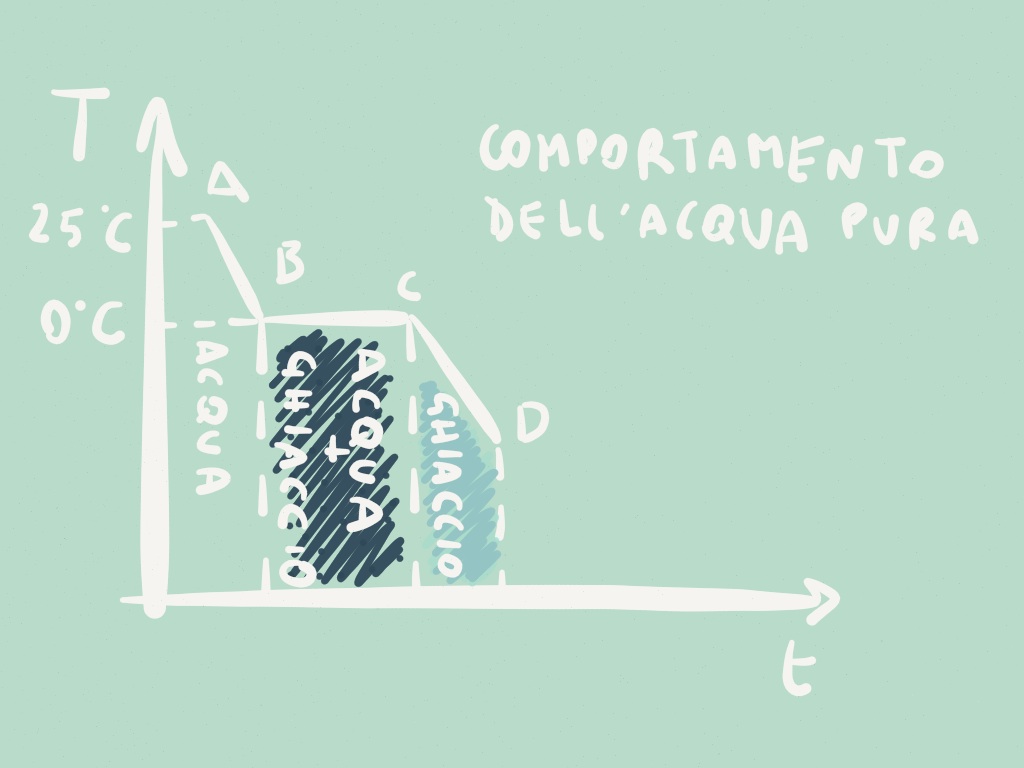
Solubilità: solubile a caldo in ambiente acquoso e in soluzioni debolmente acide o alcaline, meno solubile in acqua fredda e nei solventi organici.
pH soluzione acquosa al 10%: 6,0±1,5.
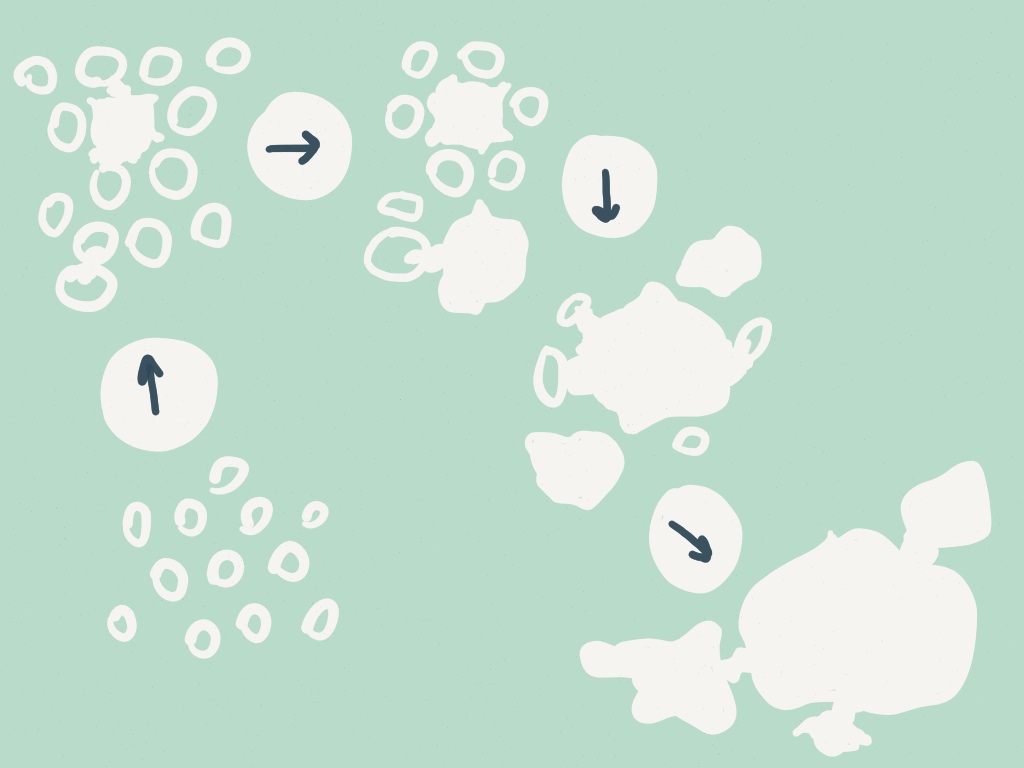
Produzione: come le ciclodestrine, l’inulina trova impiego in diversi campi ma in particolare farmaceutico ed alimentare e viene estratta con un processo simile a quello utilizzato per lo zucchero da barbabietola a partire generalmente da Dahlia variabilis, Helianthus tuberosus o Cichorium intybus. Qui un esempio schematico delle fasi del processo produttivo.
Impiego: quantum satis/at libitum. Diversi sono i dosaggi tipici così come lo sono le applicazioni possibili in ambito lattiero-caseario, dolciario, conserviero e nutraceutico. A concentrazioni che superano il 15% ha la capacità di formare strutture molto cremose che possono gelificare. Questa sua caratteristica la rende un ingrediente “fat-replacer” / “fat-mimetic” in alcuni prodotti alimentari. A dosaggi più bassi nei prodotti surgelati stabilizza i cicli di congelamento-scongelamento (freeze-thaw stability) conferendo anche buona texture (mouth-feel sensation) e per questa ultima caratteristica è utilizzato anche nelle varianti di maionese e yogurt a minor contenuto di grasso. Le viene attribuito un indice glicemico (GI) pari a zero e fornisce come fibra, in accordo al Regolamento (UE) 1169/2011, 2 kcal/g.