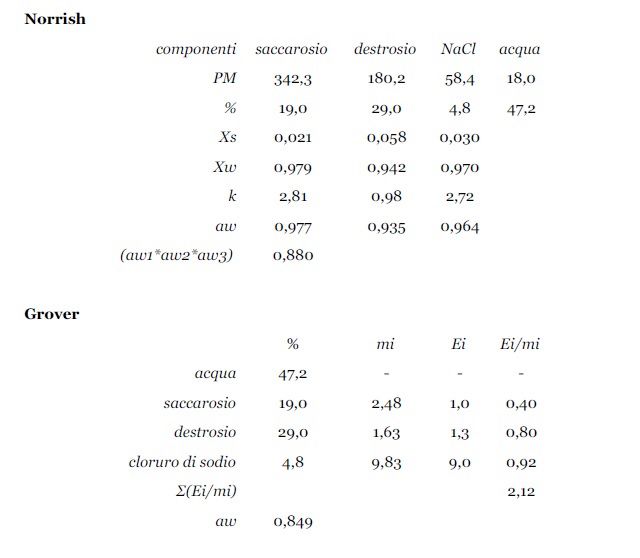
Come anticipato qui, con un esempio proviamo a calcolare l’attività dell’acqua di una soluzione acquosa a base di destrosio (29%), saccarosio (19%) e cloruro di sodio (4,8%) mettendo a confronto il risultato sperimentale con quello previsto da due modelli, quello di Norrish e quello di Grover che non avevamo citato nella prima parte.
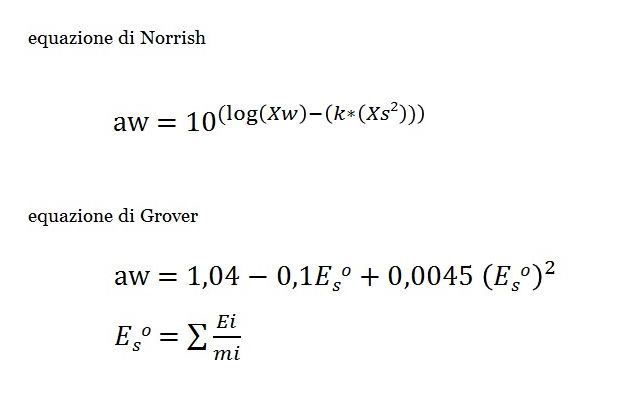 Per sistemi alimentari più complessi si possono adattare questi e altri modelli anche se le variabili che entrano in gioco, ad esempio i parametri di processo e le interazioni tra ingredienti, rendono inevitabili scostamenti teorici più o meno ampi rispetto a quelli realmente misurati.
Per sistemi alimentari più complessi si possono adattare questi e altri modelli anche se le variabili che entrano in gioco, ad esempio i parametri di processo e le interazioni tra ingredienti, rendono inevitabili scostamenti teorici più o meno ampi rispetto a quelli realmente misurati.
In merito all’esempio citato, con il primo modello abbiamo trovato un valore di 0,880 e con il secondo di 0,849. A livello strumentale il dato è risultato pari a 0,866 a 22 °C.
Relativamente all’equazione di Norrish, Xs e Xw si riferiscono rispettivamente alle frazioni molari di soluti e acqua. K è una costante tabulata che è specifica per ogni sostanza (saccarosio, glucosio, cloruro di sodio, ecc..) e considera eventuali interazioni in soluzione.
Nell’equazione di Grover invece, mi si riferisce ai grammi di componente per grammo di acqua presenti nel sistema mentre Ei è la costante specificata dei componenti stessi (proteine, gomme, sali, glucosio, ecc..). Nel caso specifico i grammi sono stati riferiti a 100, considerando quindi la percentuale.
La bibliografia inerente questo argomento è abbastanza ampia e nei prossimi post forniremo alcuni riferimenti così da poter indirizzare ad un approfondimento quanti fossero interessati.
Se vuoi ricevere il foglio di calcolo esemplificativo utilizzato per l’elaborazione dei dati, scrivici qui.
Let’s food together!